日期:2022/02/04 IAE
人體營養利用的動態適應
作者:Tatiana El Bacha,博士 (Instituto de Bioquímica Médica, Universidade Federal do Rio de Janeiro), Mauricio R. M. P. Luz, Ph.D. (Instituto Oswaldo Cruz, Fundacao Oswaldo Cruz) & Andrea T. Da Poian, Ph.D. (Instituto de Bioquimica Medica, Universidade Federal do Rio de Janeiro) © 2010 Nature Education
引文:El Bacha, T.、Luz, M. 和 Da Poian, A. (2010) 人類營養利用的動態適應。 自然教育
食物進,能量出? 不是那麼簡單。 細胞如何滿足我們身體不斷變化的能量需求?
儘管人體每天經歷的營養可用性波動,但人體的能量需求必須得到滿足。 那麼,我們不同的電池是如何使用燃料分子的,這個過程涉及哪些因素呢? 我們可以將人體視為一個動態環境,其中每個細胞必須不斷地有時周期性地切換被氧化和/或產生的底物類型。 這種適應至關重要,只有通過控制能源轉換和利用所涉及的幾種監管機制才能實現。 此外,當我們考慮到有機體每天接觸的各種生理條件時,細胞適應變得更加重要。 例如,晚上我們通常不吃東西,這是一種後來被早餐打斷的“禁食”,而在其他時間我們只是在休息或鍛煉。 在這些情況下,細胞可用的營養物質的類型和數量會突然發生變化。

(↑點入)
人體細胞中的能量代謝和 ATP 合成
在大多數動物細胞中,三磷酸腺苷(ATP)是一種具有高勢能的化合物,是化學能的主要載體。一般來說,合成 ATP 分子的能量必須從相當複雜的燃料分子中獲得。人體使用三種類型的分子來產生驅動 ATP 合成所需的能量:脂肪、蛋白質和碳水化合物。
線粒體是哺乳動物合成 ATP 的主要場所,儘管一些 ATP 也在細胞質中合成。脂質分解為脂肪酸,蛋白質分解為氨基酸,碳水化合物分解為葡萄糖。通過一系列氧化還原反應,線粒體將脂肪酸、氨基酸和丙酮酸(細胞質中葡萄糖降解的最終產物)降解為幾種中間化合物,以及還原的電子載體輔酶 NADH 和 FADH2(圖 1) )。中間體進入三羧酸 (TCA) 循環,也產生 NADH 和 FADH2。這些還原的電子載體本身通過電子傳輸鏈被氧化,同時消耗氧氣和 ATP 合成(圖 1)。這個過程稱為氧化磷酸化。
一百多個ATP分子由一分子脂肪酸的完全氧化合成,近四十個ATP分子由氨基酸和丙酮酸氧化產生。通過葡萄糖分子轉化為丙酮酸,在細胞質中合成了兩個 ATP 分子。這些分子氧化所需的裝置(酶)和物理環境都包含在線粒體中。
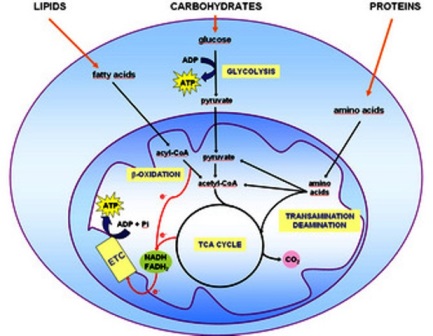
氧化代謝中燃料分子入口點的示意圖
脂類、蛋白質和碳水化合物的降解分別產生脂肪酸、氨基酸和丙酮酸。 這些分子進入線粒體中的三羧酸 (TCA) 循環,被完全氧化為 CO2,同時 NAD+ 和 FAD 分別還原為 NADH 和 FADH2。 在電子傳遞系統中,電子從還原的輔酶傳遞到 O2,導致 ATP 合成。
充滿活力和活力:線粒體如何滿足神經元能量需求 2013
線粒體是細胞的發電站,但與教科書中描述的靜態結構不同,它們是動態的細胞器,在細胞中移動,將能量輸送到需要的地方。這些細胞器相互融合,然後分裂;一些看起來錨定,而另一些則更自由地四處移動,當它們受損時,它們會被自噬體吞噬。總之,這些過程——線粒體運輸、融合和裂變以及線粒體自噬——最好用“線粒體動力學”一詞來描述。這些事件背後的分子機制相對眾所周知,但神經元中的精確動力學仍然存在爭議。神經元對線粒體構成了特殊的後勤挑戰;這些能源供應商如何設法通過長軸突向細胞的遠處部分提供必要的能源供應?迄今為止,大多數神經元線粒體動力學研究都使用了培養的神經元、果蠅幼蟲、斑馬魚胚胎,偶爾在靜息小鼠神經中進行了實驗。然而,Marija Sajic 及其同事在本期《公共科學圖書館生物學》上的一項新研究提供了對活體麻醉小鼠休息和電活動神經元的線粒體動力學的體內觀察。
所有細胞都需要能量,因此線粒體動力學與體內的每種細胞類型相關;然而,在長期伸展的神經元中,線粒體面臨的挑戰可以說要大得多。神經元在長距離內高度分隔——例如,人類運動神經元的長度可能超過一米——能量需求和這些需求的定位可能會以一種明顯且不可預測的方式發生變化。為了滿足這些需求,線粒體需要能夠感知能量需求並使其做出相應反應的機制和機制。這一證據來自體外模型,也來自果蠅、蠕蟲或離體青蛙神經,為神經元線粒體運輸的活動依賴性調節提供了見解 [1],[2]。然而,細胞模型、器官培養或切除的神經如何很好地反映成年哺乳動物軸突的情況存在局限性。儘管早期有報導稱線粒體在體內的軸突運輸成像[3]-[6],但沒有研究關注成年哺乳動物中神經元活動依賴的線粒體運動。 Marija Sajic 及其同事現在首次觀察了在仔細暴露的小鼠大隱神經中受到刺激後的線粒體運動 [7],讓我們深入了解這些細胞器所採用的動力學,以應對神經元對不同激發水平的反應所面臨的能量挑戰。
線粒體運動
神經元結構的複雜性需要高度有組織的細胞器運輸。線粒體沿著微管、神經絲和肌動蛋白軌道移動,基於微管的運動是軸突中最重要的(圖 1)。考慮到軸突的長度(人體坐骨神經中的一個軸突大約 1 m 長)和線粒體運動的速度(平均速度大約為 0.7 µm/s,最大為 3.4 µm/s),一個線粒體可以採取從神經元體到突觸末端需要數週的時間 [8]。
圖1
線粒體動力學的分子機制。
(A) 線粒體運輸由沿微管移動貨物的分子運動蛋白驅動蛋白(KIF,用於向神經末梢順行運輸)和動力蛋白(DYN,用於向細胞體逆行運輸)驅動。銜接蛋白 TRAK1 和 TRAK2 將這些運動蛋白與位於線粒體外膜的 Miro 蛋白連接起來。此外,錨定蛋白,如 Syntaphilin (SNPH),可以將線粒體停靠在需要高能量的區域。 (B) 線粒體外膜蛋白 Mitofusin (Mfn) 1 和 2 可以將兩個線粒體連接在一起並啟動其外膜的融合。外膜蛋白 Fis1 和/或 Mff 募集細胞溶質 Drp1,然後介導線粒體的收縮和斷裂。 (C) 線粒體去極化導致 PINK1 在外膜上的積累,從而將泛素連接酶 Parkin 募集到線粒體。 Parkin 泛素化線粒體外膜蛋白(包括 Mfn2 以停止融合,可能 Miro1 以停止運動)並標記這些線粒體以供自噬體降解。
線粒體運輸由分子運動蛋白驅動,這些分子運動蛋白利用 ATP 水解產生的能量;驅動蛋白將細胞器順行帶向神經末梢,而動力蛋白則將它們逆行帶回細胞體。線粒體由兩種驅動蛋白 KIF1B 和 KIF5B 轉運,前者的突變與 Charcot-Marie-Tooth 遺傳性神經病 2A1 型有關 [9],這是一種周圍神經系統疾病,其特徵是觸覺和肌肉組織在各個部位逐漸喪失身體部位。動力蛋白與驅動蛋白有一些相似之處,但作為多聚體複合物發揮作用,需要動力蛋白與微管相互作用。此外,基於肌動蛋白的肌球蛋白馬達與短距離線粒體運動有關(例如,在樹突內),最近的一項研究表明,肌球蛋白反對基於微管的線粒體軸突運輸 [10]。
需要幾種銜接蛋白和錨蛋白來將線粒體與馬達連接起來,例如線粒體 Rho (Miro) GTPase [11]。 Miro 蛋白與運輸驅動蛋白 (TRAK) 家族銜接蛋白 TRAK1 和 TRAK2 結合,將線粒體與基於微管的馬達連接起來 [12]。 Miro1 蛋白還充當線粒體運動的鈣敏感調節劑——當細胞質 Ca2+ 水平增加時,Miro1 會阻止線粒體運動 [13]-[15]。
最後但同樣重要的是,還涉及對接蛋白質或靜態錨。線粒體運動是跳躍和雙向運動以及靜止對接的組合。在神經元中,大約三分之一的軸突線粒體是高度運動的,而三分之二是靜止的。越來越多的證據表明,線粒體通過將蛋白質停靠在具有高能量需求的特定位置而錨定。
聚變和裂變動力學
線粒體融合和裂變事件背後的分子機制相對眾所周知(圖 1;在 [16] 中進行了綜述)。負責融合的分子 Mitofusin-2 和 OPA1 中的突變分別與兩種神經系統疾病 Charcot-Marie-Tooth 神經病、2A2 型 [17] 和常染色體顯性遺傳性視神經萎縮有關 [18]、[19]。所涉及的分子機制之外的聚變和裂變事件的調節不太清楚。聚變和裂變不是隨機發生的,而是形成一個循環,裂變通常跟隨聚變。線粒體裂變機制可能以某種方式感知線粒體的長度,並在線粒體過大時變得活躍,而在線粒體變小時則停止。相反,線粒體融合事件在很大程度上依賴於線粒體運輸。只有當兩個線粒體相遇時才會發生融合,並且運動的線粒體更有可能彼此相遇。在培養的皮層神經元中,線粒體之間每 14 次接觸中只有一個會導致融合。與細胞系相比,神經元軸突中融合和裂變事件的頻率相當低,並且在不同的神經元亞型之間也存在差異(培養的混合皮質神經元中為 0.023±0.003 融合/線粒體/分鐘和 0.023±0.003 裂變/線粒體/分鐘和 0.045在培養的小腦顆粒神經元中,±0.006 融合/線粒體/分鐘和 0.039±0.005 分裂/線粒體/分鐘)[20]。
線粒體融合和裂變的確切生理目的是什麼?一方面,頻繁的融合和裂變事件有助於維持細胞內線粒體群的同質性,從而保持其健康。受損的線粒體會與健康的線粒體融合,稀釋損傷並共享“健康”線粒體的成分。另一方面,有人提出裂變可以將線粒體基因組的突變拷貝穿梭到“垃圾”線粒體中,然後被自噬體破壞[21]。如果是這樣,那麼融合裂變循環將與線粒體自噬一起幫助改善線粒體群體的健康。
融合和裂變的另一個目的是控制線粒體長度。在穩態條件下,融合和裂變事件的數量完美平衡,從而保持線粒體長度穩定。然而,當融合機制被抑製或裂變機制被激活時,我們會看到線粒體縮短。一個常見的誤解是,較短的線粒體必然表明裂變激活。顯然,這種表型同樣可能是由於融合受到抑制[20]。
儘管線粒體長度被認為對細胞生理學很重要,但它究竟為何如此重要仍不清楚。更長或更短的線粒體可能在功能(ATP 產生、活性氧生成)或對凋亡刺激或自噬去除的敏感性上有所不同(在 [22] 中進行了綜述)。然而,線粒體裂變的激活(或融合的抑制)不僅會導致線粒體變短/變小,還會增加每個細胞的線粒體數量。更多(更小)線粒體允許更精確地微調其分佈,而更少(更大)線粒體分佈更粗糙(不太均勻),這可能導致某些隔室的能量不足。
去:
體內線粒體動力學的相關性
大多數線粒體動力學研究依賴於培養的細胞和神經元,其中線粒體可以使用線粒體靶向熒光蛋白或染料進行可視化(圖 2;視頻 S1 和 S2)。線粒體動力學也在無脊椎動物中進行了研究,特別是在果蠅幼蟲運動軸突中,但我們對哺乳動物神經元組織中線粒體動力學的信息非常有限。
圖 2
基於圖像的技術來量化神經元中的線粒體動力學。
(A) 可以使用延時顯微鏡觀察神經元中的線粒體運動,這些神經元要么轉染表達線粒體靶向熒光蛋白的質粒,要么裝載線粒體特異性熒光染料(視頻 S1)。在圖像系列中手動或使用特定軟件包自動跟踪線粒體。可以從獲得的數據中計算出各種運動參數(例如,移動和靜止線粒體的數量和百分比,線粒體的運行或軌蹟的數量、長度和方向,它們的最大和平均速度)。 (B) 線粒體融合和裂變可以使用可光激活或可光轉換的線粒體靶向熒光蛋白(如 Kikume [20]、[23])來測量。中間面板顯示了發射綠色和紅色的線粒體之間的融合事件,在線粒體基質的內容物混合後產生黃色融合產物(視頻 S2)。下圖顯示了聚變之後發生了裂變事件。可以在整個延時系列中跟踪光活化線粒體的命運,併計算融合率和裂變率。 (C) 檢測表達線粒體靶向 pH 依賴性蛋白 Keima [24]、[25] 的初級皮層神經元細胞體中的線粒體自噬,其激發光譜從 440 nm 變為 586 nm(照片中的綠色變為紅色)被遞送到酸性溶酶體,從而能夠輕鬆量化線粒體自噬。另一種方法是量化自噬體標記 (EGFP-LC3) 與線粒體標記的共定位。
在本期 PLOS Biology 中,Sajic 等人。 [7] 提出了一項分析活體小鼠軸突中線粒體運輸的研究。該研究表明,對隱神經(股神經的一個分支)進行電刺激和藥理學刺激都會增加軸突中的線粒體運輸。有趣的是,靜止的線粒體變得更短,這表明融合/裂變過程被用來產生更多的移動線粒體。令人驚訝的是,這些可移動的線粒體並沒有在 Ranvier 節點附近聚集,而是沿順行方向向周圍神經末梢移動。人們普遍認為,線粒體通常存在於能量需求高的區域,例如需要 ATP 動員小泡進行神經傳遞的突觸末端和動作電位再生的部位,例如 Ranvier 節點。人們可能期望這些位點表現出最大的能量需求波動,並且線粒體會響應生理衝動活動進出這些區域。然而,Sajic 等人提供的數據。表明感覺軸突的外圍末端,而不是 Ranvier 的節點,代表生理高頻傳導過程中代謝需求特別高的部位。總之,這些結果表明線粒體運輸和融合裂變動力學在體內緊密協調,以滿足神經元波動和分隔的能量需求。事實上,這項研究是最早證明體內線粒體動力學相關性的研究之一。