日期:2024/10/10 IAE
具有深遠生理重要性的微小RNA
Victor Ambros 和 Gary Ruvkun 發現了 microRNA,這是一類新型的微小 RNA 分子,在基因調控中發揮著至關重要的作用。他們在小線蟲中的突破性發現揭示了基因調控的全新原理。事實證明,這對包括人類在內的多細胞生物至關重要。事實證明,MicroRNA 對於生物體的發育和功能至關重要。

2024 年諾貝爾生理學或醫學獎聯合授予 Victor Ambros 和 Gary Ruvkun,以表彰其“發現 microRNA 及其在轉錄後基因調控中的作用”
諾貝爾獎是一項享有盛譽的國際獎項,由瑞典斯德哥爾摩諾貝爾基金會管理,並由瑞典發明家和企業家阿爾弗雷德·諾貝爾的遺產資助。獲得此榮譽的個人或組織被稱為諾貝爾獎得主。
- 根據官方新聞稿,今年的諾貝爾獎委員會表彰安布羅斯和魯夫昆發現了控制基因活動的關鍵原理。我們染色體中的訊息可以比喻為所有細胞的指南。每個細胞都包含相同的染色體,這意味著它們都具有相同的基因組和指令。
- 儘管具有相同的遺傳物質,但不同類型的細胞(例如肌肉細胞和神經細胞)具有獨特的特徵。這些差異的發生是由於基因調控,它允許細胞只選擇它們需要的指令,確保正確的基因在每種細胞類型中活躍。
- Victor Ambros 和 Gary Ruvkun 在研究不同類型的細胞如何發育時發現了 microRNA(一類對基因調控至關重要的小 RNA 分子)。
- 他們的發現引入了基因調控的新概念,這對於包括人類在內的多細胞生物的功能至關重要。
科學背景
發現 microRNA 及其在轉錄後基因調控中的作用
多細胞生物從單細胞祖先演化而來,其中每種細胞類型都獲得了專門的功能,需要越來越複雜的基因調控機制。除了作用於調控序列的 DNA 結合因子介導的轉錄基因調控外,隨著生物體複雜性的持續演化,其他形式的控制系統也出現了。數億年來,編碼微小非編碼 RNA 分子(即所謂的 microRNA)的基因在多細胞生物的基因組中擴展,對 mRNA 穩定性和蛋白質翻譯發揮轉錄後控制。直到1993 年Victor Ambros 和Gary Ruvkun 發現之前,MicroRNA 及其基因調控模式仍然完全未知。秀麗隱桿線蟲線蟲。 Ambros 的實驗室克隆了 lin-4 基因,並令人驚訝地發現它並沒有編碼蛋白質。相反,它編碼了一段短的 22 核苷酸非編碼 RNA。同時,Ruvkun 的實驗室確定 lin-4 透過 3' 非翻譯區 (3'UTR) 中的多個元件調節 lin-14。在比較序列資訊後,他們定義了短非編碼 lin-4 RNA 和 lin-14 的 3'UTR 元件之間的部分序列互補性。這讓人們首次了解一種概念上新穎的調控 RNA:microRNA。 2000 年,Ruvkun 的實驗室發現了高度保守的 let-7 microRNA,導致了隨後在包括人類在內的不同動物物種中鑑定同源 microRNA。這引發了在整個動物界鑑定 microRNA 的激烈克隆和測序工作,最終發現 microRNA 包含一大群控制蛋白質編碼基因龐大網絡的調節因子。 Ambros 和 Ruvkun 的發現完全出乎意料,揭示了一種由 microRNA 介導的進化上保守的轉錄後調節機制,在動物發育和成體組織功能中發揮關鍵作用。
介紹
控制每個基因何時何地轉錄成 RNA 並翻譯成蛋白質是生命的基本面向(圖 1)。例如,胰島素是在胰島的β細胞中產生的,而視蛋白是在眼睛的視網膜中產生的。精確的細胞類型特異性基因調控指令由遺傳物質本身編碼,並由序列特異性 DNA 結合蛋白發揮作用。雅各布 (François Jacob) 和雅克莫諾 (Jacque Monod) 因發現基因調控機製而榮獲 1965 年諾貝爾生理學或醫學獎。 DNA 結合轉錄因子的全部功能在單細胞和多細胞真核生物中得到了很好的保存(King 等,2008),而多細胞生物中已經出現了額外的基因調控層,以確保在任何給定時間正確生成RNA 和蛋白質在每種細胞類型中。
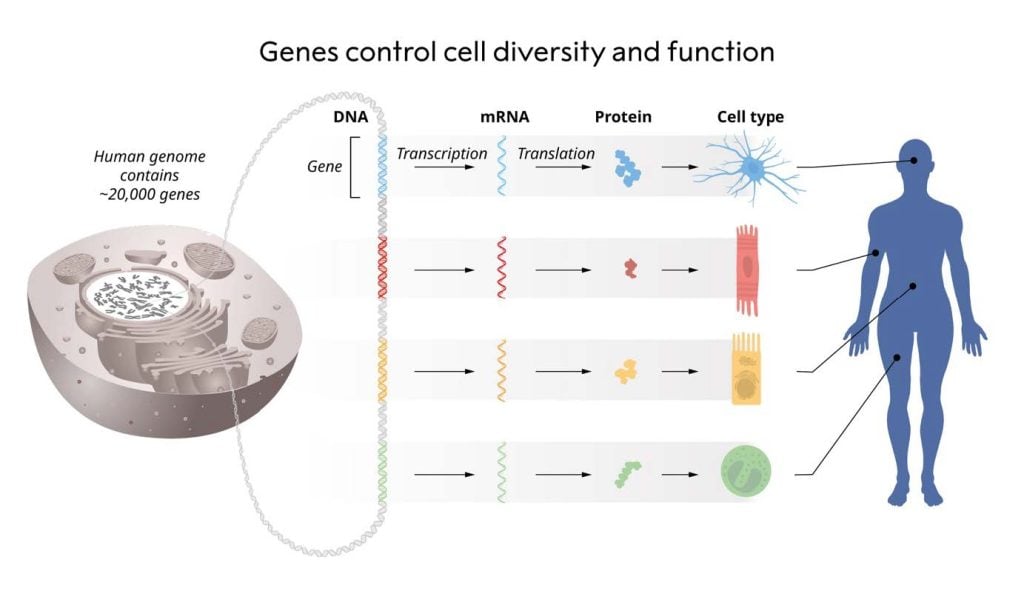
圖 1. 細胞類型特定功能的調節。每個細胞都包含一組相同的染色體,因此也包含完全相同的一組基因。當每種細胞類型中僅活化這些基因的選定子集時,細胞類型特異性功能就會出現。 © 諾貝爾生理學或醫學委員會。生病的馬蒂亞斯·卡倫
真核模型生物對於基因研究具有無價的價值,產生了許多意想不到的發現。西德尼布倫納 (Sydney Brenner) 在五十多年前引進了線蟲秀麗隱桿線蟲 (C. elegans)。這種生物體的世代時間短、透明且易於基因操作,促進了廣泛的研究。 Sydney Brenner、John Sulston 和 Robert Horvitz 利用秀麗隱桿線蟲揭示了器官發育過程中細胞分裂、分化和細胞死亡是如何受到基因控制的,他們因此獲得了 2002 年諾貝爾生理學或醫學獎。
1970 年代,Brenner 實驗室對秀麗隱桿線蟲進行誘變篩選,發現了 lin-4 突變體 (e912)。這些蠕蟲表現出驚人的表型:許多細胞類型和形態結構完全不存在,並且由於外陰發育失敗而積累卵(圖2)(Horvitz和Sulston,1980;Chalfie,Horvitz和Sulston,1981),似乎來自重申特定細胞譜系的發育計劃。
在 lin-4 突變體中觀察到的線蟲發育的主要破壞表明 lin-4 編碼發育時間的主調節因子。研究人員對大量表現出各種時間發育缺陷的其他異時性突變體進行了表徵,其中包括 Horvitz 實驗室發現的第二種突變體 lin-14(Ferguson、Sternberg 和 Horvitz,1987)。
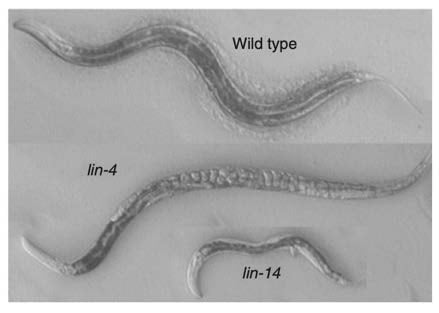
圖 2. 具有發育缺陷的異時線蟲突變體。線蟲 lin-4 和 lin-14 突變體破壞動物發育。突變的 lin-4 蠕蟲重申細胞譜系的發育程序,以累積內部卵而不形成外陰,而 lin-14 突變體很小且缺乏幼蟲發育。 蠕蟲改編自(Ambros,2008)
與此同時,維克多·安布羅斯 (Victor Ambros) 與大衛·巴爾的摩 (David Baltimore) 一起獲得脊髓灰質炎病毒基因組結構和複製博士學位後加入了霍維茨實驗室。作為博士後研究員,Ambros 立即開始對異時突變體進行遺傳分析,並確定 lin-14 具有與 lin-4 突變體中觀察到的發育時序缺陷相反的發育時序缺陷(圖 2)。在 lin-14 突變體中,幼蟲程序完全不存在(Ambros 和 Horvitz,1984)。值得注意的是,Ambros 後來發現 lin-4 是 lin-14 的負調節因子(Ambros,1989)。
在此期間,加里·魯夫昆 (Gary Ruvkun) 在弗雷德里克·奧蘇貝爾 (Frederick Ausubel) 的指導下完成了細菌遺傳學博士學位。在歐洲旅行時,他在了解異時突變體的細胞譜系分析後對線蟲遺傳學產生了興趣(Chalfie、Horvitz 和 Sulston,1981;Ruvkun、Wightman 和 Ha,2004)。隨後與 Martin Chalfie 和 Robert Horvitz 的討論進一步激發了他利用線蟲來研究這些問題的興趣。 1982年,Ruvkun開始在Walter Gilbert和Robert Horvitz實驗室共同進行博士後研究。
透過 microRNA 發現轉錄後基因調控
在霍維茲實驗室,Ambros 和 Ruvkun 開始了他們對克隆 lin-14 的長期追求。當時,識別由遺傳學定義的基因座的 DNA 序列是一項具有挑戰性的任務。經過多年的持續實驗,他們使用經典的限制性片段長度多態性方法成功鑑定了該區域(Ruvkun 等,1989)。在此期間,安布羅斯和魯夫昆都獲得了教職,安布羅斯在哈佛大學,魯夫昆在麻省總醫院和哈佛醫學院。致力於解決他們的問題,他們繼續進行分子分析。 Ruvkun 證明 lin-14 是一種核蛋白,在發育過程中具有階段特異性表達,在 L1 階段表達較高,並且在 lin-4 和 lin-14 突變體中發生改變(Ruvkun 和 Giusto,1989)。有趣的是,發現了 3'UTR 缺失的 lin-14 功能獲得突變體(Ruvkun 和 Giusto,1989;Wightman 等,1991),導致 lin-14 蛋白檢測時間延長到 L1 階段之外(Arasu,懷特曼和魯夫昆,1991;懷特曼等人,1991)。 3'UTR 元件的破壞對蛋白質序列沒有影響,因此,Ruvkun 推測作用於 mRNA 穩定性、核輸出或翻譯的轉錄後機制可能介導 lin-14 中的時間轉換(Wightman 等人) .,1991)。
與已鑑定的幾種 lin-14 突變體相比,僅發現了 lin-4 中的一種突變體 (e912)。 Ambros 實驗室著手透過限制性片段長度多態性和 Southern blot 探測來克隆 lin-4 基因。 「沿著染色體行走」並反覆測試較小的基因組片段拯救突變 lin-4 表型的能力,他們精確定位了 693 bp Sal I 限制性酶片段。經過幾輪開放閱讀框預測和克隆重測序以排除錯誤後,他們開始懷疑 lin-4 基因可能是非編碼 RNA,因為其開放閱讀框架 (ORF) 序列很短。引入線蟲序列中的移碼突變不會影響 lin-4 功能,證實了這個懷疑。 1991 年,實驗室開始透過 Northern blot 和 RNase 保護測定法探測 lin-4 轉錄本,發現了兩個長度分別為 61 和 22 個核苷酸 (nt) 的短 RNA 轉錄本(圖 3)。
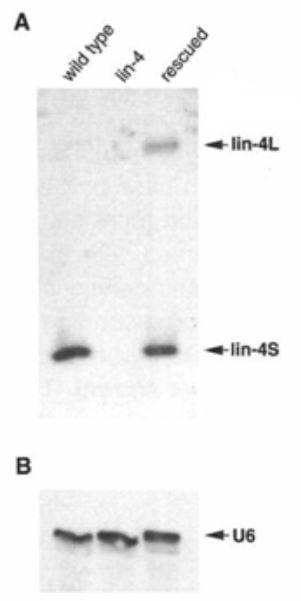
圖 3. 兩個短 lin-4 轉錄本的鑑定。與U6 上樣對照相比,野生型、lin-4 (e912) 突變體和用Sal I 片段拯救的lin-4 (e912) 突變體的總RNA 的Northern 印跡,用放射性標記的lin-4 RNA 探針探測。 (李、範鮑姆和安布羅斯,1993)。
在獨立推導了 lin-4(Ambros 實驗室)和 lin-14(Ruvkun 實驗室)的序列後,Ambros 和 Ruvkun 於 1992 年 6 月 11 日晚上交換了 lin-4 和 lin-14 基因的序列數據。兩人都注意到 lin-4 非編碼 RNA 和 lin-14 3'UTR 中的多個元件之間存在明顯的部分互補性(圖 4)。
認識到他們的觀察的重要性,兩個實驗室進行了一系列額外的實驗,證明 lin-4 microRNA 透過與 3'UTR 中的元件鹼基配對來調節 lin-14 mRNA。 1993 年,在《Cell》上連續發表的兩篇論文報導了他們的開創性發現(Lee、Feinbaum 和 Ambros,1993;Wightman、Ha 和 Ruvkun,1993)。
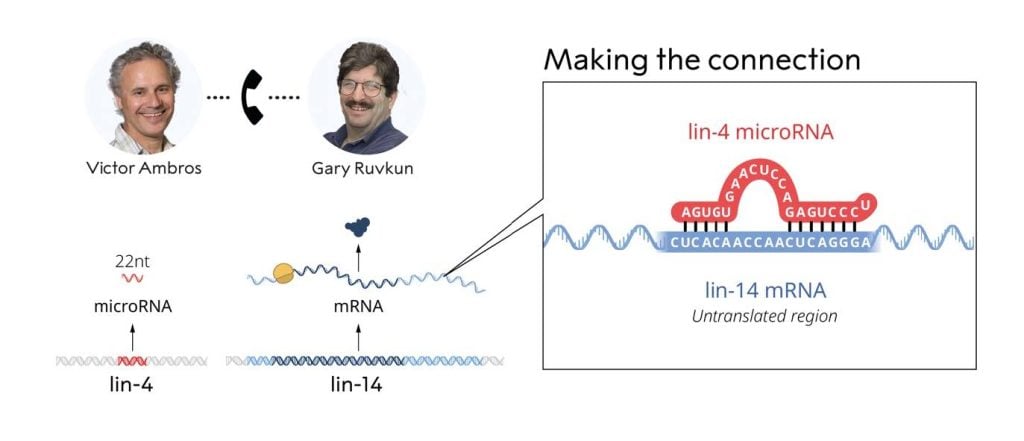
圖 4. lin-4 和 lin-14 RNA 中的互補序列元件。透過比較 lin-4 和 lin-14 的克隆序列,發現短的 22 nt lin-4 RNA 與 lin-14 3’UTR 中的重複元件具有部分互補性。 © 諾貝爾生理學或醫學委員會。生病的馬蒂亞斯·卡倫
Ambros 的實驗室使用線蟲 lin-4 序列來識別其他線蟲物種(C. briggsae、C. remanei 和 C. vulgaris)中相應的含有 lin-4 的克隆。這些實驗表明,來自其他線蟲的 lin-4 克隆可以挽救線蟲的 lin-4 突變表型。他們還篩選了 20,000 多條誘變染色體,以確定第二個 lin-4 突變體 (ma161),其中包含單核苷酸突變。值得注意的是,這種突變存在於互補序列中,進一步支持了 lin-4 microRNA 和 lin-14 3'UTR 元件之間互補鹼基的功能意義(Lee、Feinbaum 和 Ambros,1993)。
Ruvkun 的實驗室比較了野生型和 lin-14 功能獲得突變體中 lin-14 蛋白和 RNA 的含量。突變體中的 Lin-14 蛋白升高了 4 至 7 倍,而 RNA 量沒有差異,這表明 lin-14 在轉錄後水平(即 RNA 轉錄後)受到調節。將 lin-14 3'UTR 轉移到報告基因中會導致報告基因的轉錄後調節,這與 lin-14 類似,顯示異源 3'UTR 足以控制 mRNA 翻譯。迭代地將 lin-14 3'UTR 的較小片段轉移到報告基因中,直到鑑定出功能性的 124 nt 長 3'UTR 片段。此 3’UTR 區域包含幾個與 lin-4 部分互補的序列,此外該區域在 C. briggsae 中是保守的(Wightman、Ha 和 Ruvkun,1993)。
根據所有物種的核苷酸序列綜合資料庫對新發現的 lin-4 microRNA 進行計算分析,發現僅在其他秀麗隱桿線蟲(例如線蟲)中存在匹配序列。 C. briggsae。一個關鍵問題仍然存在:microRNA 的存在是線蟲獨有的特性,還是它在整個動物界中具有深遠的功能後果?
進化上保守的let-7 microRNA的發現
繼第一個 microRNA lin-4 的突破性發現之後,又過了七年,第二個 microRNA 基因 let-7 才被發現。 Ruvkun 實驗室進行了遺傳篩選,重點在於抑制 lin-14 和 egl-35 位點突變菌株的合成不孕表型的突變體(Reinhart 等,2000)。 Let-7被發現編碼一個短的21-nt RNA,與各種異時基因的3’UTR表現出互補性,包括lin-14、lin-28、lin-41、lin-42和daf-12。 let-7 的缺失導致幼蟲細胞在成蟲階段的命運再次發生。第二個 microRNA 基因的發現表明,microRNA 可能在調節發育過程中細胞譜系形成的階段特異性時間方面發揮更廣泛的作用。
當 Ruvkun 實驗室發現 let-7 基因與 lin-4 不同時,下一個突破出現了,它在多種動物中在進化上是保守的。將let-7 microRNA 序列與核苷酸資料庫進行比較,揭示了果蠅和人類的匹配序列(Pasquinelli 等,2000)。線蟲中 let-7 的一個已確定目標是 lin-41(Reinhart 等,2000),這是一種在斑馬魚和果蠅中具有直向同源物的蛋白質。令人欣慰的是,斑馬魚和果蠅 lin-41 直系同源物的 3’UTR 都顯示出與 let-7 的互補性(Pasquinelli 等,2000)。此外,在多個人體組織中發現了let-7 microRNA,顯示它與一般哺乳動物細胞中的基因表現有關。
與線蟲類似,對果蠅發育的分析證明了let-7 microRNA的時間調節,顯示let-7在昆蟲、甲殼類動物和線蟲中具有保守的作用(Pasquinelli等,2000)。值得注意的是,即使在軟體動物和環節動物的成年階段也檢測到了顳葉 let-7 的表達(Pasquinelli 等,2000),這些物種不會透過幼蟲狀態發育。此外,脊椎動物沒有明顯的幼蟲階段,但在發育過程中表現出時間調節的let-7表達,包括在成年斑馬魚中的強烈表達。引人注目的是,let-7 的表達被發現在兩側對稱動物(即左右對稱的動物)中受到時間調節,並且可能是在這些動物與雙胚層物種(即從兩個而不是三個初級胚層發育而來的動物)分化之後演化而來的。進化上高度保守的let-7的發現大大增加了人們對microRNA作為基因表現轉錄後調節因子的興趣。

圖 5.let-7 RNA 表現和更普遍的 microRNA 的演化保守性。左:後生動物的進化樹,突出顯示具有可檢測到的 let-7 microRNA 表達 (+) 或未檢測到 let-7 表達的分支 (-)。具有相似 let-7 RNA 表達發育模式的物種(早期無 let-7;但成年期表達 let-7)以「Dev.」表示。 (帕斯奎內利等人,2000)。右圖:MicroRNA 基因在多細胞生物的基因組中演化和擴展了 5 億多年。
發現 let-7 後,多個研究實驗室試圖透過小 RNA 克隆來識別人類和其他物種中的其他 microRNA。 Thomas Tuschl 的實驗室從人類和果蠅組織中克隆了新的microRNA(Lagos-Quintana 等,2001),David Bartel 的實驗室從線蟲中分離出了新的microRNA(Lau 等,2001),Ambros 實驗室也是如此(Lee 和安布羅斯,2001)。現在的集體證據令人信服:動物體內存在大量的調節性 microRNA,可能在基因調節中發揮重要作用。此後,分子生物學和定序技術的進步已經導致人類基因組中一千多個 microRNA 基因的鑑定。目前,miRBase 是一個 microRNA 基因資料庫,包含 271 個生物體的 38,000 多個髮夾前體和 48,860 個成熟 microRNA 基因序列(Kozomara、Birgaoanu 和 Griffiths-Jones,2019)。甚至病毒也被發現編碼 microRNA 基因(Pfeffer et al., 2004)。
其他 microRNA 的克隆和全基因組序列的可用性為定義 microRNA 和 3'UTR 區域之間的鹼基配對規則提供了越來越多的機會。 David Bartel、Christopher Burge 和 Stephen Cohen 實驗室進行的關鍵研究(Lewis 等人,2003 年;Stark 等人,2003 年;Brennecke 等人,2005 年;Lewis、Burge 和 Bartel,2005 年)闡明了整體規則使用組合實驗和比較基因組學方法進行microRNA 目標辨識。這些研究表明,microRNA 通常與目標 mRNA 具有部分互補性,主要是在 microRNA「種子」區域。這項工作還揭示了每個 microRNA 可能調節多個蛋白質編碼基因,因為許多 3'UTR 表現出與 microRNA 種子序列互補的序列的過度保守(Brennecke 等,2005;Lewis、Burge 和 Bartel,2005)。有趣的是,與細胞類型或譜系特異性 microRNA 共表達的基因缺乏該特定 microRNA 的目標位點。相反,此類 microRNA 標靶位點在鄰近細胞和組織中表達的基因中很常見(Farh 等人,2005 年;Stark 等人,2005 年)。這些觀察結果強化了這樣的假設:microRNA 在多細胞生物的細胞譜系形成和細胞類型穩定性中具有重要功能。
MicroRNA的生物發生和功能
在複製額外的 microRNA 基因的同時,幾個研究小組付出了巨大的努力致力於了解 microRNA 的生物發生和作用機制(Bartel,2004)。 microRNA 基因轉錄的策略各不相同。許多 microRNA 基因是獨立的轉錄單位,有時呈簇狀,而其他基因則位於蛋白質編碼基因的內含子內。規範初級 microRNA (pri-microRNA) 由 RNA 聚合酶 II 轉錄,具有髮夾結構序列。此髮夾作為微處理器在細胞核中進行處理的底物,這是一種含有Drosha 核酸內切酶的異三聚體複合物,可切割兩條鏈以產生前體microRNA (pre-microRNA),通常長度為60-70 個核苷酸,首次在Ambros 實驗室中被檢測到(圖2)。 Exportin 5 和 RAN-GTP 促進前 microRNA 轉運至細胞質。 Dicer(一種最初在 Greg Hannon 實驗室(Bernstein et al., 2001)中發現的核酸內切酶)進行後續處理,形成 microRNA 雙股體。有效的 microRNA 鏈被加載到含有 Argonaute 蛋白的沉默複合物上,而另一條「過客」鏈則被取代(Schwarz 等,2003)。一旦 microRNA 鏈被加載到沉默複合物中,它就可以透過減少翻譯和/或 mRNA 降解來對 mRNA 進行序列特異性負調節。這種調節涉及銜接蛋白TNRC6 和聚腺苷酸結合蛋白PABPC,它們招募去腺苷酸酶複合物,縮短mRNA 聚腺苷酸尾部,導致mRNA 降解和翻譯抑制,取決於細胞環境,例如細胞環境。發育階段和細胞類型。
處理和執行 microRNA 功能的機制也用於其他基於 RNA 的沉默機制,通常稱為 RNA 幹擾 (RNAi)。這些包括小幹擾 RNA (siRNA)、內源性 piwi 相關 RNA (piRNA) 和重複相關小幹擾 RNA (rasiRNA)。雙股 RNA 可以誘導序列依賴性基因沉默的發現(Fire 等,1998)為 Andrew Z. Fire 和 Craig C. Mello 贏得了 2006 年諾貝爾生理學或醫學獎。 RNAi 主要作為針對病毒感染(在複雜性較低的植物和動物中)和針對不必要的基因組移動元件活性的防禦機制,而 microRNA 在整個發育過程中和成體細胞類型中對 mRNA 施加轉錄後控制。為此,microRNA 已經進化出與其目標 mRNA 序列的部分互補性,以「調整」對每個 mRNA 目標的各自影響,而例如siRNA 通常是外源性的,與被切割的特定 RNA 標靶序列完全互補。 1999年,David Baulcombe顯示植物中的轉錄後基因沉默涉及對目標序列具有特異性的短RNA的加工(Hamilton和Baulcombe,1999),進一步連接了不同領域的觀察結果。
microRNA的進化及其生理作用
microRNA 基因的出現和擴展與更複雜生物體的演化密切相關(圖 5)。在早期兩側對稱動物進化過程中,microRNA 基因的數量顯著增加(Grimson 等,2008;Wheeler 等,2009),其功能作用在原口動物和後口動物分化之前的最後一個共同兩側對稱動物祖先中被推論出來(Christodoulou 等,2010)。從那時起,隨著複雜生物體中更特化的細胞類型和組織的進化,已經獲得了數百個額外的 microRNA 基因。甚至在早期後生動物海綿、植物和兩種單細胞真核生物中也發現了 MicroRNA 基因。因此,microRNA 可能在演化過程中多次出現,包括大約 6 億年前多細胞動物的早期譜系,或者植物和動物的祖先在 10 億年前就已經進化出了 microRNA(Moran 等人,2017 年)。值得注意的是,許多進化上古老的 microRNA 基因在後來進化的生物體中是保守的,並且這些基因很少在進化過程中丟失,這一事實證明了它們在基因調控中的關鍵作用。
microRNA 在後生動物發育和組織功能中的重要作用已透過 microRNA 生物發生途徑中成分的消除得到證實。 Dicer 負責處理細胞質中的 pre-miRNA,其缺失對於小鼠和斑馬魚來說是胚胎致死的(Bernstein 等,2003;Wienholds 等,2003)。在果蠅和小鼠中移除單一或一組 microRNA 基因也會導致強烈的表型(Bartel,2018)。然而,單一 microRNA 基因的作用可能會被掩蓋,這可能是由於共享目標定義種子序列的幾個 microRNA 基因的冗餘作用。雖然系統中的冗餘對研究單一 microRNA 基因的功能構成了障礙,但它也證明了系統的穩健性,並解釋了為什麼它不能輕易地被病毒等操縱。
為了強調microRNA 的基本作用,需要注意的是,進化上最保守的microRNA 基因(兩側對稱動物生物體共有的基因)在胚胎髮育早期發揮作用,而在哺乳動物中專門進化的microRNA 在胚胎髮育後期發揮作用(DeVeale, Swindlehurst-Chan 和 Blelloch,2021)。相較之下,物種特異性的 microRNA 基因通常在成體細胞類型中發揮作用,而不是在胚胎發育中發揮作用。這些模式在不同進化保守性的 microRNA 基因的系統性敲除實驗中顯而易見。 microRNA 在動物發育過程中的具體調節作用包括發育時機、細胞命運的形成和穩定性、一般生理學和穩態(DeVeale、Swindlehurst-Chan 和 Blelloch,2021)。
透過在基因轉殖小鼠中選擇性去除 Dicer,已經闡明了成年細胞和組織中 microRNA 的功能。 B 細胞成熟過程中早期移除 Dicer1 會導致前 B 細胞階段的分化停止 (Koralov et al., 2008)。神經元中胚胎第 15.5 天的 Dicer1 消融導致出生後早期死亡,隨後出現小頭畸形、樹突分支細化減少和樹突棘長度增加(Davis 等,2008)。在有絲分裂後小腦浦肯野細胞中,兩週齡時 Dicer1 缺失引發小腦變性和共濟失調發作(肌肉運動不協調)(Schaefer 等,2007)。類似地,中腦多巴胺能神經元中 Dicer1 的缺失導致進行性神經元缺失和運動活動減少 (Kim et al., 2007)。在其他幾種細胞類型和組織中也觀察到了嚴重的表型,證明了 microRNA 在發育過程和成體細胞類型功能中的關鍵作用。
透過與特定 microRNA 基因或生物發生途徑成分的突變相關的綜合徵,microRNA 對人類發育和功能的重要性變得顯而易見。 DICER1 症候群是一種罕見的遺傳性疾病,由 DICER1 基因突變引起,使個體容易患腎臟、甲狀腺、卵巢、子宮頸、睪丸、腦部、眼睛和肺部的腫瘤。通常,DICER1 的一個等位基因具有種系突變,使其失去功能,從而降低細胞中功能性 DICER1 蛋白的數量。這些人容易受到額外的體細胞突變的影響,因此經常在兒童時期患上腫瘤(Foulkes、Priest 和 Duchaine,2014)。
單一 microRNA 基因的鹼基配對部分(即種子區域)很短,這使得它們不太可能被偶然突變改變。然而,已知 microRNA 基因的種子序列中存在與疾病相關的突變。其中包括與進行性聽力損失相關的miRNA-96 突變(Mencía 等人,2009 年;Soldà 等人,miRNA-184 突變導致EDICT 綜合徵,這是一種罕見的眼病,伴隨虹膜發育不全、內皮營養不良和先天性白內障) (Hughes 等人,2011 年;Iliff、Riazuddin 和Gottsch,2012 年;Lechner 等人,2013 年),以及導致先天性骨骼疾病的miRNA-140-5p 突變(Grigelioniene 等人,2019年)。
結論
感謝 Ambros 和 Ruvkun 以及基於他們的發現的許多同事的開創性發現,基因調控的新維度已經被揭示。細胞核中的蛋白質調節 RNA 轉錄和剪接,而 microRNA 控制細胞質中 mRNA 的翻譯和降解。這種意想不到的轉錄後基因調控層在整個動物發育和成體細胞類型中至關重要,並且對於複雜的多細胞生命至關重要。
Rickard Sandberg,博士,卡羅林斯卡學院教授,(Rickard.Sandberg@ki.se),諾貝爾委員會成員
關鍵參考文獻
關鍵參考文獻
Rosalind C. Lee、Rhonda L. Feinbaum 和 Victor Ambros (1993)「秀麗隱桿線蟲異時基因 lin-4 編碼與 lin-14 具有反義互補性的小 RNA」。 《細胞》,75(5),第 843–854 頁。
Bruce Wightman、Ilho Ha 和 Gary Ruvkun (1993)「lin-4 對異時基因 lin-14 的轉錄後調節介導了秀麗隱桿線蟲的時間模式形成」。 《細胞》,75(5),第 855–862 頁。
Amy E. Pasquinelli、Brenda J. Reinhart、Frank Slack、Mark Q. Martindale、Mitzi I. Kurodak、Betsy Maller、David C. Hayward、Eldon E. Ball、Bernard Degnan、Peter Müller、Jürg Spring、Ashok Srinivasan、Mark Fishman ,John Finnerty、Joseph Corbo、Michael Levine、Patrick Leahy、Eric Davidson 和Gary Ruvkun (2000)「let-7 異時調節RNA 的序列和時間表達的保守性」。 《自然》,408(6808),第 86-89 頁。
*這些作者對這項工作做出了同等的貢獻。
由卡羅林斯卡醫學院 50 位教授組成的諾貝爾大會負責頒發諾貝爾生理學或醫學獎。其諾貝爾委員會對提名進行評估。自 1901 年以來,諾貝爾獎一直頒發給為人類福祉做出最重要發現的科學家。
Nobel Prize® 是諾貝爾基金會的註冊商標
參考
Ambros, V. (1989)“調控基因的層次結構控制線蟲幼蟲到成蟲的發育轉換”,Cell 57(1),第 49-57 頁。網址:https://doi.org/10.1016/0092-8674(89)90171-2。
Ambros, V. (2008)“我們對 microRNA 的思考的演變”,《自然醫學》,14(10),第 1036-1040 頁。可用 https://doi.org/10.1038/nm1008-1036。
Ambros, V. 和 Horvitz, H.R.(1984)“線蟲秀麗隱桿線蟲的異性慢性突變體”,《科學》(紐約州紐約),226(4673),第 409-416 頁。網址:https://doi.org/10.1126/science.64948 91.
Arasu, P.、Wightman, B. 和Ruvkun, G. (1991)“通過另外兩個異時基因lin-4 和lin-28 的拮抗作用對lin-14 進行時間調節”,基因與發育,5( 10) ),第 1825–1833 頁。網址:https://doi.org/10.1101/gad.5.10.1825。
巴特爾,D.P. (2004)“MicroRNA:基因組學、生物基因、機制和功能”,《細胞》,116(2),第 281-297 頁。可用 https://doi.org/10.1016/s0092-8674(04)00045-5。
巴特爾,D.P. (2018) “後生動物 MicroRNA”,細胞,173(1),第 20-51 頁。網址:https://doi.org/10.1016/j.cell.2018.03.006。
伯恩斯坦,E.等。 (2001)“雙齒核糖核酸酶在 RNA 幹擾起始步驟中的作用”,《自然》,409(6818),第 363-366 頁。網址:https://doi.org/10.1038/35053110。
伯恩斯坦,E.等。 (2003)“Dicer 對於小鼠發育至關重要”,《自然遺傳學》,35(3),第 215-217 頁。網址:https://doi.org/10.1038/ng1253。
布倫內克,J.等。 (2005)“microRNA 標靶識別原理”,PLoS 生物學,3(3),第 14 頁。 e85。網址:https://doi.org/10.1371/journal.pbio.0030085。
Chalfie, M.、Horvitz, H.R. 和 Sulston, J.E. (1981)“導致線蟲細胞譜系重複的突變”,Cell,24(1),第 59-69 頁。網址:https://doi.org/10.1016/0092-8674(81)90501-8。
克里斯托杜盧,F.等。 (2010)“古代動物 microRNA 和組織身份的進化”,《自然》,463(7284),第 1084–1088 頁。網址:https://doi.org/10.1038/nature08744。
戴維斯,T.H.等人。 (2008)“Dicer 的條件性喪失會破壞皮質和海馬的細胞和組織形態發生”,《神經科學雜誌》,28(17),第 4322-4330 頁。網址:https://doi.org/10.1523/JNEUROSCI.4815-07.2008。
DeVeale, B.、Swindlehurst-Chan, J. 和 Blelloch, R. (2021)“microRNA 在小鼠發育中的作用”,《自然評論》。遺傳學,22(5),第 307-323 頁。網址:https://doi.org/10.1038/s41576-020-00309-5。
Farh,K.K.-H。等人。 (2005)“哺乳動物 MicroRNA 對 mRNA 抑制和進化的廣泛影響”,《科學》(紐約州紐約),310(5755),第 1817-1821 頁。網址:https://doi.org/10.1126/science.1121158。
弗格森,E.L.,斯滕伯格,P.W.和 Horvitz, H.R. (1987)“秀麗隱桿線蟲外陰細胞譜系規範的遺傳途徑”,《自然》,326(6110),第 259-267 頁。網址:https://doi.org/10.1038/326259a0。
火,A.等。 (1998) “秀麗隱桿線蟲中雙股 RNA 的有效和特異性遺傳幹擾”,《自然》,391(6669),第 806-811 頁。網址:https://doi.org/10.1038/35888。
Foulkes, W.D.、Priest, J.R. 與 Duchaine, T.F. (2014)“DICER1:突變、microRNA 和機制”,《自然評論》。癌症,14(10),第 662–672 頁。網址:https://doi.org/10.1038/nrc3802。
Grigelioniene,G.等。 (2019)“人類骨骼發育不良中 microRNA-140 的功能獲得突變”,《自然醫學》,25(4),第 583-590 頁。網址:https://doi.org/10.1038/s41591-019-0353-2。
格里姆森,A.等。 (2008)“動物中 microRNA 和 Piwi 相互作用 RNA 的早期起源和進化”,《自然》,455(7217),第 1193-1197 頁。網址:https://doi.org/10.1038/nature07415。
.jpg)